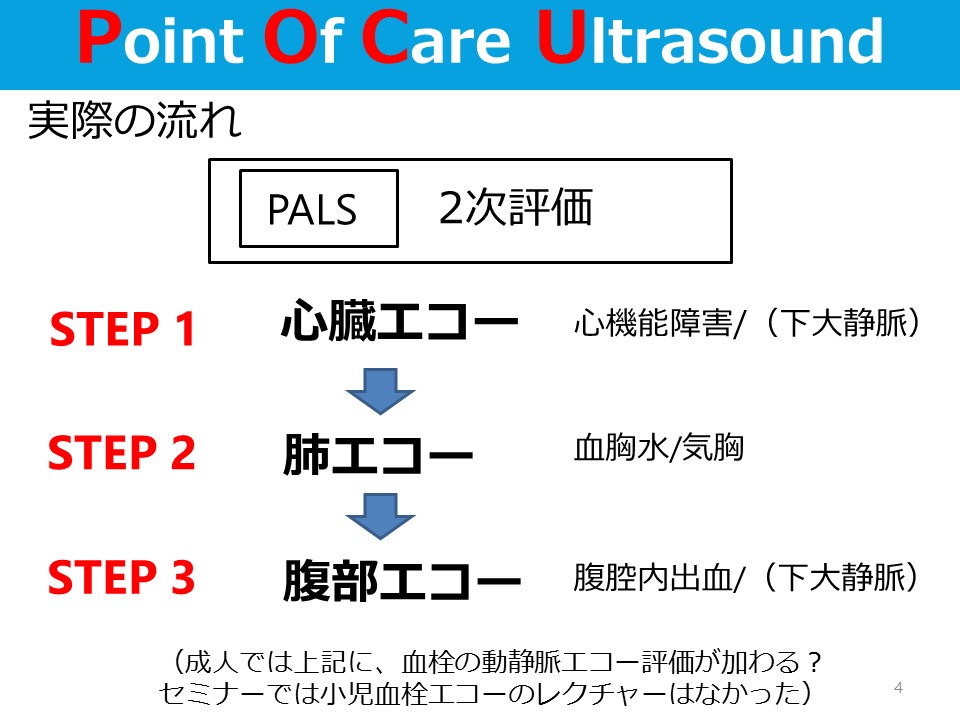
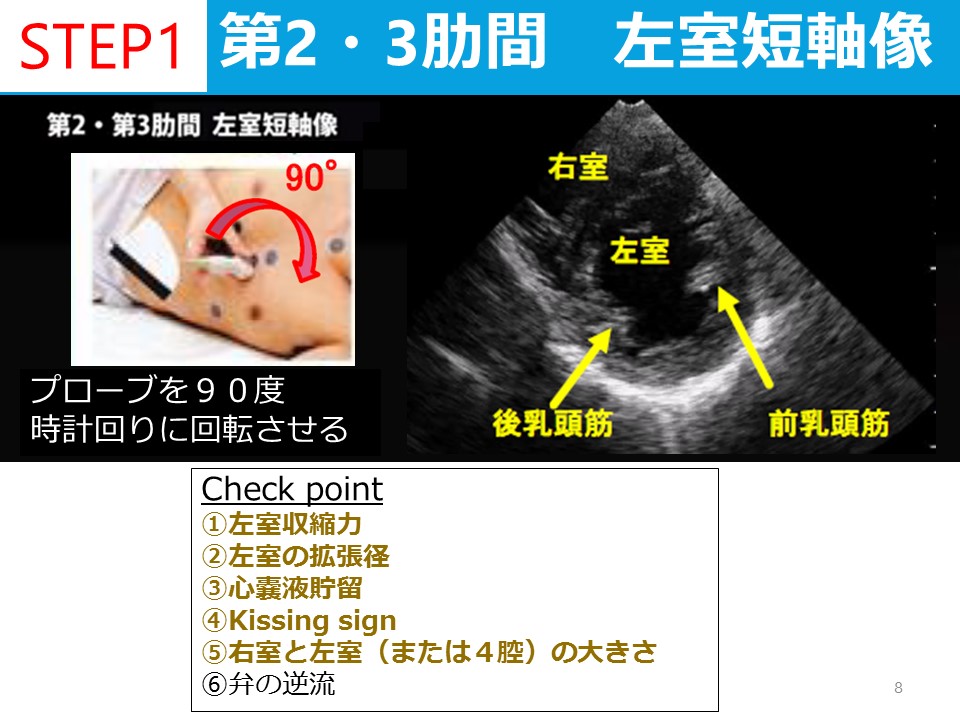
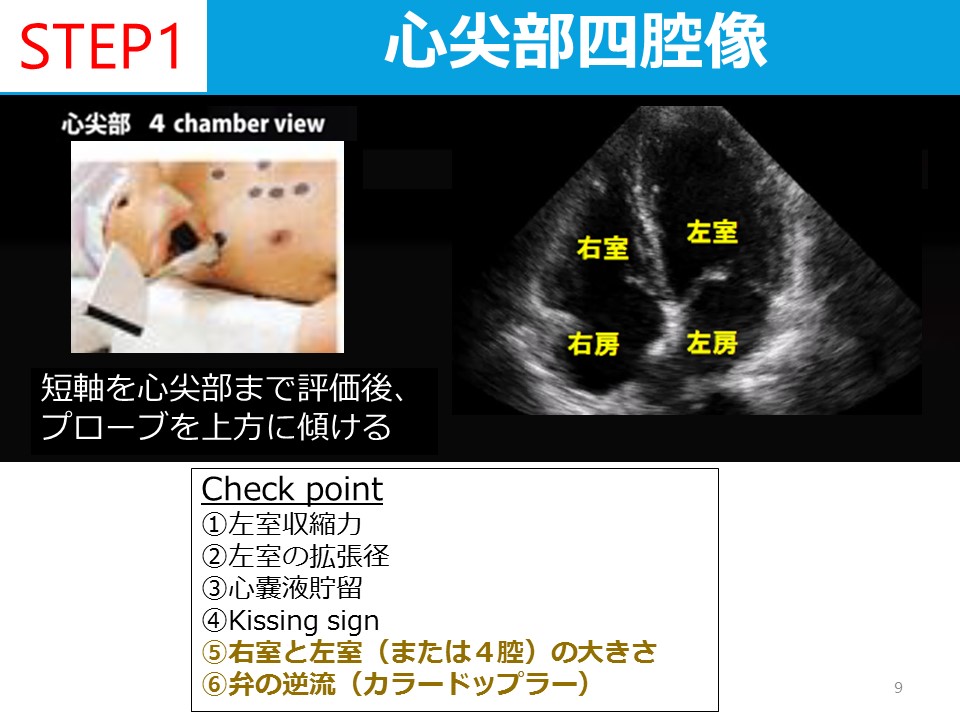
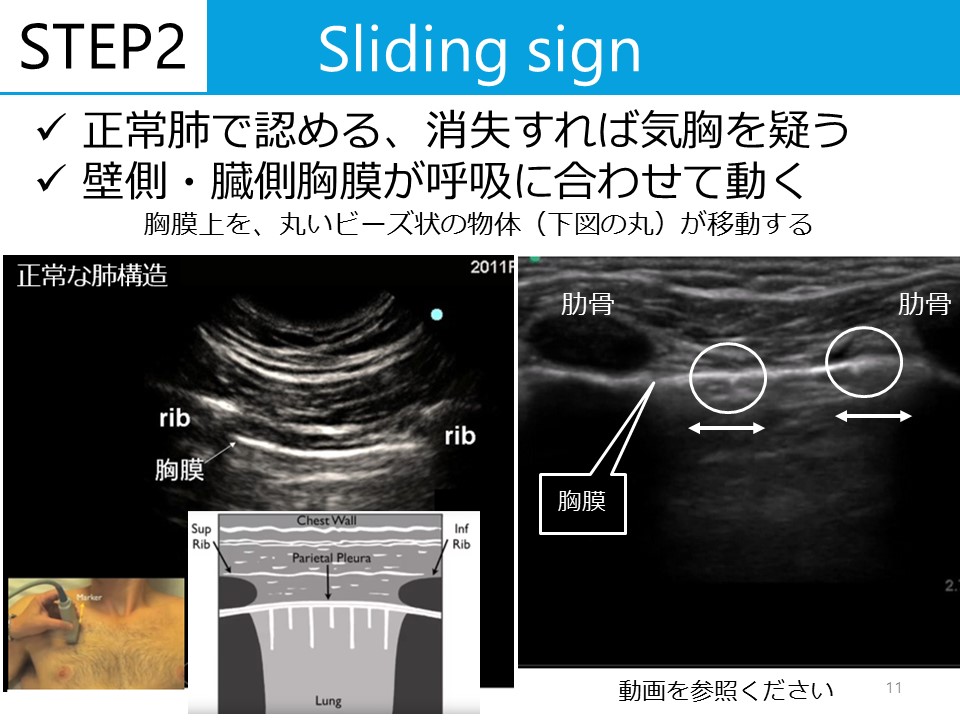
蘇生後の低酸素性虚血性脳症の管理
小児昏睡の治療と予後

last updated: Jan 04, 2018.
昏睡:入眠しているようにみえ覚醒せず、環境に対する認識を示さない
治療: 早期診断目標は脳損傷を軽減すること
気道 ⇒十分な換気の確保、気管挿管
循環 ⇒低血圧管理(脳2次損傷に寄与するため積極的に管理する)、静脈内等張液と血管拡張薬
血糖 ⇒低血糖の是正
頭蓋内圧 ⇒頭部CT所見、うっ血乳頭、、ヘルニア兆候に基づき、頭蓋内圧の増加が疑われる場合は緊急治療を推奨する ;ICP低下のための治療は①発熱治療、②ベットアップ30度、③マンニトール
痙攣 ⇒重積状態はロラゼパム0.1㎎/㎏静注、再発防止のためにはフェニトイン15-20㎎/㎏静注
温度管理 ⇒38.5度以上の高熱は脳損傷を助長する。頭蓋内圧上昇をもたらし2次的脳損傷の一因となる可能性がある
電解質異常 ⇒軽度~中等度高Na血症は是正不要。それ以外の電解質異常は治療介入。
予後
・昏睡は通常2-4週間未満の一時的な状態である。
・非外傷性脳障害後3か月以上続く場合/外傷後12ヶ月以上持続する場合は、意識改善の可能性がなく永続的昏睡と判断する。
低酸素性虚血性脳障害;HIE/外傷性脳障害;TBIの予後因子
原則、神経学的回復の可能性はHIEよりTBIでより高い。
臨床的な決定力を持つにいたる純分な予後因子はない。年齢は因子として役立たない。
⇒予後因子として、①Event24時間後の対光反射・運動反応・両側胎生感覚誘発電位が予測性高い。②心肺停止時間;(良好な神経学的予後を有した心停止生存例は)15分以下が31%、15-35分が12%、36分以上が10%である。
24時間後のGCS<5と24時間自発呼吸がない症例は重度の障害/死亡の陽性予測率が100%であった。(ただし感度は50%であるため見逃す可能性がある)
その他の予後不良因子:痙攣、低酸素症、早期低血圧など。高乳酸アシドーシス、多臓器障害(急性腎障害、肝障害)は死亡リスクと神経学的予後不良の因子。溺水患者は比較的予後良好が多い。
脳波について
昏睡状態の予後予測因子であるが、鎮静剤は脳波異常を引き起こすため予後推定の評価を困難にする。昏睡小児の予後に脳波検査を用いた研究は限定されている。
脳波検査を行う利点は、非てんかん性重積状態(nonconvulsive status epilepticus、NCSE)を特定しうる点である。
SEP(体性誘発感覚電位)は高い特異性があり、特にHIEで脳波検査より予後予測に有用である。
頭部MRIについて
頭部CTより詳細に障害部位を描出可能で、予後予測の定性評価に有用である。
last updated:April 21,2015.
臨床的評価項目
・自発運動、刺激への反応、瞳孔系と反射、角膜眼球反射、自発性呼吸の有無
HIEの予後予測に有用な臨床スコアとして、Event 48時間以内のGCS≦4、24h後の角膜・対光反射、24hまたは72hの運動反応 がない場合は予後不良(重度神経学的後遺症や死亡)が起こりうる。
特に、心停止後3日目に角膜・対光反射がないと予後は不良。
・低体温療法中、肝不全・腎不全・ショック・鎮静薬投与は、不良転帰の臨床基準推測を不正確にする。
・ミオクローヌスてんかん状態は、予後不良因子である。重度の脳虚血・脳幹脊髄損傷と関連している。
・24-72hの体性誘発電位が予後不良予測に最も有用。N20成分がないと不良。
・脳波検査の、臨床的価値は不明。鎮静・筋弛緩薬で臨床的に抑制されるてんかん重積状態を評価するために有用でありうる。
・頭部CT:通常、心肺停止直後は正常だが、3日目までに脳浮腫・皮髄境界不明瞭化を呈する。
ヒトメタニューモウイルスの臨床症状、検査所見
hMPV(ヒトメタニューモウイルス)について
2001年にRSウイルスと類似した呼吸器症状を引き起こすウイルスとしてオランダ研究グループより発見された。hMPVは培養が難しく、それまで発見されていなかったと推測されている。
エンベロープを有し、パラミクソウイルス科,ニューモウイルス亜科,メタニューモウイルス属に属する。RSVと同様に大きく2つのグループ(グループA,B)に分かれ、さらにそれぞれのグループが2つのサブグループ(サブグループ1,2)に分かれる。
ウイルス分離では、A2(47%)>B1(35%)>B2(18%)>A1の順で検出
hMPVの疫学
小児の呼吸器感染症の5~10%、成人の2~4%はhMPVが原因と考えられる。潜伏期間は4~6日間でウイルス排泄は発症後1~2週間持続する。
hMPVが検出された呼吸器感染症の児は2歳未満が最も多い。3月をピークに春に流行し、低年齢ほど入院率が高い。

hMPVの免疫

IgG抗体:
陽性率は、移行抗体が消失する6か月以上1歳未満で最も低く、その後は上昇し10歳以上で全例陽性となる。
IgM抗体:
初感染、再感染いずれでも検出され、初感染/再感染の鑑別に使用できない。再感染を繰り返す理由は、hMPV感染の再感染を防ぐのに十分な免疫が1回の感染では得られない可能性が推測される。
hMPVの臨床像
hMPVとRSV感染症の臨床症状/検査所見はほぼ同様である。
hMPVはRSVより高熱が多い(RSVの方がやや重症であるとの報告が多い)


発熱期間:4.8±1.6日
喘鳴期間:5.2±3.0日

一般的な臨床経過

hMPV陽性患者のレントゲン異常陰影:
大葉性肺炎や末梢肺胞の浸潤陰影画像はみられず、肺門を中心に中枢側の気管支炎および気管支周囲炎を示した

|
合併症 |
熱性痙攣 |
3.5% |
|
急性中耳炎 |
15.8% |
|
|
喘息の悪化 |
8% |
稀だが脳炎/脳症の報告もみられる。低出生体重児、高齢者、骨髄移植などの免疫不全状態の患者では重症の下気道感染症の原因となる。
hMPVの検査
2014年からイムノクロマト法により抗原定性が『画像検査により肺炎を強く疑われるhMPV感染症の6歳未満の患者』に保険適応となった(特異度:97%、感度:73%)
感染性ぶどう膜炎
ぶどう膜炎のカテゴリーとして感染症・眼病変・全身性免疫性疾患がある。
■感染症原因■
①細菌性/スピロヘータ
非定型抗酸菌・ブルセラ・猫ひっかき病・レプロシー・レプトスピラ・Lyme病・プロピオンバクテリウム・ロッキー山紅斑熱・梅毒・結核・Whipple病
②ウイルス性
チクングニヤ・サイトメガロ・エボラ・EBウイルス・単純ヘルペス・帯状疱疹ウイルス・HIV・HTLV・ムンプス・パレコウイルス・風疹・麻疹・西ナイル熱・ジカウイルス
③真菌性
アスペルギルス・ブラストマイコーシス・カンジダ・コクシジオイデス・クリプトコッカス・ヒストプラズマ・PCP・スポロトリコーシス
④寄生虫
アカントアメーバ・有鉤嚢虫・オンコセルカ・犬猫回虫症・トキソプラズマ
さらに、ぶどう膜炎と間違われる病態として有名なのが、虚血・白血病・悪性リンパ腫・眼悪性黒色腫・色素分散症候群・網膜色素変性症・網膜芽細胞腫などがあります。これら悪性腫瘍関連のブドウ膜炎もどきも押さえておく。
ぶどう膜炎の診断のすすめ方
http://tmdu-ganka.jp/workshop/document/uveitis.pdf
Basedow病で『眼球突出』はなぜ起こるか?
Basedow病で『眼球突出』はなぜ起こるか?
Basedow病眼症では後眼窩組織におけるTSH受容体の発現が増強していることが報告されている。
Basedow病眼症ではTSH受容体に対する自己免疫機序により後眼窩組織にもリンパ球浸潤をきたし、炎症がおこる.その結果、後眼窩組織の線維芽細胞は活性化してGAGの産生が高まり間質の浮腫をきたす。
それ以外にMüller筋/上眼瞼挙筋/外眼筋/脂肪組織/涙腺に炎症をきたして眼球突出・上眼瞼後退・涙液分泌低下などが生じる。続発性には、眼瞼・結膜・角膜・眼球運動・視神経網膜に障害を来たす。重症例では複視や視力低下を来す。また片眼性に症状が出現することもある。
追加して:
Basedow病眼症(甲状腺眼症)はBasedow病患者の25~50%,慢性甲状腺炎患者の2%にみられる。
眼症患者の20% はBasedow病の既往のない甲状腺機能正常者(euthyroid Graves’disease)または低下症(hypothyroid Graves’disease)の患者にみられる.
Basedow病眼症は、喫煙との関連が報告されている。タバコの煙に含まれるチオシアネートなどの化学物質が甲状腺の働きを抑えたり、異常な免疫反応をひき起こしたり、低酸素などをおこし後眼窩組織におけるグリコサミノグリカン(GAG)産生を高めるなどの機序が想定されている。
Basedow病眼症の治療指針:

clinical activity score(CAS)
後眼窩の自発痛,上方視,下方視時の痛み,眼瞼発赤,眼瞼腫脹,結膜発赤,結膜浮腫,涙丘腫脹の7 項目からなる活動性スコア。合計3 点以上であれば活動性があると判定し、ステロイド療法や放射線療法などの免疫抑制療法の適応となる。
重症度:
軽症→日常生活に支障が無い
中等症→眼症状により日常生活に深刻な障害をきたし,2 mm以上の眼瞼後退,中等度ないし重度の軟部組織所見,正常より3 mm以上の眼球突出,側視時および常時の複視がみられる場合
軽症→失明のリスクがある場合
日本における溶連菌感染後関節炎とリウマチ熱の特徴の違い
A retrospective study: Acute rheumatic fever and post-streptococcal reactive arthritis in Japan
Allergol Int. 2017;66(4):617-620
□PICO
P:急性リウマチ熱(ARF)および連鎖球菌反応性関節炎(PSRA)の患者
I:ARF患者44例
C:PRSA患者21例
O:ARFとPSRAの発生率や症状の違い
◇試験の概要
デザイン:アンケートを用いたレトロスぺクティブ研究
地域:日本
登録期間:2010年〜2015年
症例数:323病院で診断された65例、(3~15歳のARF群44例、2~15歳のPRSA群21例)
◇結果
発症年齢はARFは8.5歳(3-15)歳、PSRAは8.2歳(2-15歳)。2群間で年齢および性別に関して有意差なし。咽頭炎からの潜伏期間は、PSRA患者で優位に短い。

症状・所見
ARF:心臓炎(61.4%)、関節炎(82%)、舞踏病(6.8%)、輪状紅斑(15.9%)、皮下結節(2.3%)
PSRA:関節炎(100%)、皮下結節(4.8%)、心臓炎・舞踏病・輪状紅斑なし。
ARFではPRSAと比較し、心炎症例・CRP値・ASOが優位に高い。血沈には有意差がない。
膝、足首、手、肘、股関節の関節炎は、指の小関節を除き頻度に差がない。
ARF患者の指関節炎は、PSRA患者よりも有意に少ない。ARF患者では移動性関節炎が優位に多い。

急性期治療
ARF患者(95.5%)とPSRA患者(81%)の両方で抗生物質療法の初期治療が頻繁に使用。
ARF患者:アスピリン19/44人(43.2%)、イブプロフェン5/44(11.4%)、ナプロキセン3/44(6.8%)
PRSA患者:アスピリンは4/21(19%イブプロフェン5/21(23.8%)、ナプロキセン4/21(19%)
コルチコステロイドは、ARFでより高頻度。
2か月以上持続した関節炎は、ARF患者の方がPSRA患者よりも頻度が低かった(0%対28.6%)。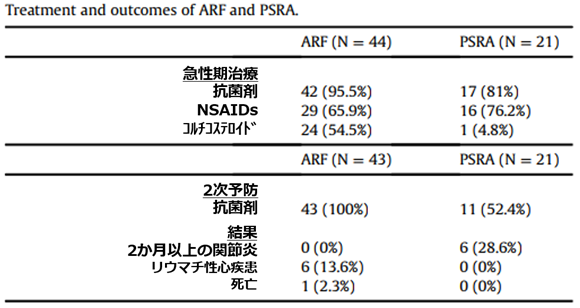
議論
PSRAはGAS感染エピソードの平均7日後に発生、ARFはGAS感染エピソードの平均20.5日後に発生した。
PSRAがARFと異なる疾患かという問題は答えが出ていないが、治療に関しての違いは、二次予防が推奨されるかどうかである。ARFとPSRAとを区別する診断基準がないため、PSRAと診断された患者はARFを有する可能性があるという懸念がある。この研究では、PSRA症例に心炎は認めなかった。
他文献でPastore らはPSRAを含む心臓炎の無症候例を同定するために、心エコー検査がARFを疑う全症例でRutineに実施するべきであると報告している。
神経学的診断法
<3段階診断法>
①解剖学的診断:患者の愁訴および神経学的診察所見から病変部位を決定する。
②病因的診断:症状の発症様式から病因を決定する。
③臨床診断:病変部位、病因および患者の年齢における疾患頻度などを基にして疾患を決定する。
<病因的診断法>
神経筋疾患のおもな病因(9つ)→血管障害性、炎症性(感染性および免疫性)、占拠性(腫瘍性)、変性、遺伝性、機能性、脱髄性、代謝性、中毒性
①突発完成発症:発症時刻(何時何分)を特定できる。→血管障害、機能性疾患(てんかん、片頭痛など)
②急性発症:1週間以内で症状が極期に至る。→炎症性、代謝性、中毒性
③亜急性発症:数週間から数か月で極期に至る。→占拠性、炎症性(結核性、真菌性髄膜炎が代表的)
④慢性発症:半年以上にわたってゆっくりと進行。→変性、遺伝性
⑤突発再発性:血管奇形、機能性(神経痛発作、てんかんなど)、代謝性(低血糖など)
⑥急性再発性:自己免疫性疾患(多発性硬化症、神経ベーチェット病、重症筋無力症など)
心筋梗塞に酸素投与は必要か?
心筋梗塞に酸素投与は必要か?
DETO2X-AMI臨床試験. N Engl J Med 2017. Aug 28.
背景:心筋梗塞疑いの患者に対して日常的な酸素投与の臨床効果は現在まで不明確。
酸素投与により虚血心筋に、より多くの酸素供給が可能になることを根拠に行った、酸素投与により梗塞サイズ拡大や合併症の抑制を報告している小規模研究はある。
しかし、大規模試験(AVOID Trial)で酸素投与の有害性が示された(正常レベル以上の血中酸素濃度が冠動脈の収縮を引き起こし、活性酸素を生成し潜在的に再灌流傷害に寄与する。AVOID trialでは酸素投与群で梗塞巣が大きかった)
論文のPICOは何か?:
P:心筋梗塞が疑われる患者
I:酸素投与あり(FaceマスクでO2:6L/分を6~12h投与)
C:酸素投与なし
O:1年後の全死亡
方法:心筋梗塞疑い患者を対象に、SPO2:90%以上の患者を酸素投与群/無酸素酸群に分けたランダム化比較試験。酸素投与は6L/分をFaceマスクで6~12h投与した)
対象:
スウェーデンで登録された6629人が対象。403人が除外され、6226人を最終的に解析。
対象の基準:30歳以上、6h以内に心筋梗塞症状(胸痛、心不全症状)を有する、SPO2:90%以上、心電図で虚血変化、心筋トロポニンT/I上昇 のいづれかを有する
除外基準:心停止、すでに酸素投与を実施している
結果:
酸素投与平均時間は11.6h、治療終了時の平均SPO2は酸素投与群99%、酸素非投与群97%であった。低酸素血症は酸素投与群で1.9%(62人)、酸素無投与群で7.7%(254人)であった。
入院中にトロポニンの最高値は酸素投与群で946.5ng/ml、酸素無投与群で983.0ng/mlであった。主要エンドポイントは1年後の死亡率とした。酸素投与群で5.0%(3311人中166人)、酸素無投与群で5.1%(3318人中168人)で有意差は無かった(Hazard ratio 0.97、P=0.80)。
1年以内に心筋梗塞のため再入院したのは、酸素投与群3.8%(126人)、酸素無投与群3.3%(111人)であった(Hazard ratio 1.13、P=0.33)。
結論:
低酸素血症を伴わない心筋梗塞疑い患者に、Routineで酸素投与を行っても1年後の全死亡率は変わらなかった。心筋梗塞患者に限定したサブグループ解析でも同様の結果であった。
多型紅斑(多型滲出性紅斑)の治療
多型紅斑の治療
up to dateより
Davidら、last update: Jul 20, 2017.
|
一般事項:
多型紅斑は、皮膚上に特徴的な標的様病変の出現を特徴とする急性免疫介在性疾患である
病変は、時に口腔・生殖器・眼の粘膜を含むびらん・水疱を伴う
Erythema multiforme major:粘膜病変を伴う多型紅斑を指す
Erythema multiforme minor:粘膜病変のない多型紅斑を指す
一般的には感染によって誘発され、単純ヘルペスウイルス(HSV)が最もCommonである
重大な後遺症なしに数週間で改善する。少例は年経過で再発しうる。粘膜関与を有する多型紅斑とSJSは異なる疾患である
病因別
多型紅斑の重症度または持続時間に対する感染症の急性治療の効果に関するデータはほとんどない
HSV感染の発生後平均して8日目に現れHSV感染治療が必要ない時期に発生する⇒HSV関連多型紅斑の出現後の経口抗ウイルス剤による治療が、発疹の臨床経過に影響を与えないことを示唆している
マイコプラズマ・ニューモニエ:
感染原因の治療が粘膜皮膚病変の持続期間または重症度に及ぼす影響についての研究はない
一般的に、治療は活動感染症の管理のために実施する
薬剤:
新規薬剤に起因すると考えられる場合、中止する。
急性期治療
急性治療は、疾患の重篤度に応じて変わる。
軽度なら、疼痛や掻痒感の軽減を目的とした治療で十分である。
全身性グルココルチコイド療法は、重度の口腔粘膜病変を有する患者に考慮すべきである。
重度の粘膜病変を有する衰弱した多型紅斑患者にのみ経口ステロイドの短期投与を推奨する
通常開始用量は、40~60㎎/日のプレドニゾンを2〜4週間で徐々に漸減する
軽度:
皮膚病変のみ、または口腔粘膜病変が限局する場合
管理は症状の緩和を行い、皮膚灼熱間や掻痒感に局所コルチコステロイド、経口抗ヒスタミン剤を用いる
痛みを伴う口腔内びらんは、リドカイン、ジフェンヒドラミン、制酸薬の混合物を含む高効能の局所コルチコステロイドゲルおよびうがい薬で治療する
重度:広範囲の口腔粘膜病変を有する場合
重度の疼痛で、経口摂取できないことがある。
全身性グルココルチコイドは、症状の重症度を低下させ、疾患の経過を短縮させる試みにおいて、しばしば使用されるが質の高いEvidenceはない。
(再発性経口多型紅斑を有する11人の患者に、経口プレドニゾン(最初は40〜60mg /日、その後は2〜3週間にわたり漸減)が唯一有効な治療であった。
しかしながら、グルココルチコイドが疾患活性を部分的に抑制するだけであり、疾患の慢性化および発作の持続期間のリスクを増加させる可能性があるという懸念を表明している研究者もいる。
眼病変:
長期の後遺症を予防するため、眼科医に直ちに紹介する
SJSでは、ステロイド点眼剤が推奨されている。潤滑点眼剤(非保存ヒアルロン酸やカルメロース点眼剤など)の使用も重要である
予後不良因子:
以下の特徴は、再発する患者の疾患制御予後が好ましくない
- 特定の原因を特定できない
- 継続的な抗ウイルス療法による改善しない
- 重度口腔病変
- グルココルチコイド療法の約1年間の使用
- 2つ以上の免疫抑制剤の使用歴
再発性EMの予防治療:
年6回以上の再発例、衰弱した多型紅斑のエピソードを有する例:全身性の予防療法の候補者である。抗ウイルス薬で改善しない患者には、免疫抑制療法または免疫調節療法が用いられる。
抗ウイルス剤の選択
再発性EMの初期治療は、以下のレジメン1つを6か月間行うことを推奨する
- アシクロビル- 1日2回400 mg
- バラシクロビル- 1日2回500 mg
- ファムシクロビル- 1日2回500mg
抗ウイルス剤によって治療に対する反応が異なる可能性がある。
⇒バラシクロビルが寛解誘導する可能性が高いことを示唆されている
(ただし、アシクロビルおよびファムシクロビルよりもバラシクロビルの優位性示すのに十分なEvidenceはない:アシクロビル療法失敗後のバラシクロビル誘発性多型紅斑が寛解した症例報告や、バラシクロビルを含む多数の治療法に失敗したヘルペス関連多型紅斑がファムシクロビル投与;500mg 1日1〜3回で完全寛解した報告がある。)
多型紅斑/多型滲出性紅斑の病因、鑑別、診断
Erythema Multiforme(多型紅斑)
MICHELE Rら. Am Fam Physician 2006;74:1883-8.
概要
多形紅斑は、感染または薬物に対する過敏反応であると考えられる皮膚状態である
遠位優位の左右対称な多型な紅斑、丘疹、特徴的な「標的病変」からなる
軽度例は後遺症なく改善し、治療を必要としない
再発症例は、アシクロビル投与で加療される。アシクロビルに対する反応がない患者は、より高い経口バイオアベイラビリティの投薬を必要とし、バラシクロビルまたはファムシクロビルに対して応答する可能性がある
抗ウイルス療法にもかかわらず多形紅斑が再発する場合は、さらなる治療のために皮膚科医に紹介するべきである
スティーブンス・ジョンソン症候群[SJS]、中毒性表皮壊死症(TEN)を含め疾患の臨床スペクトルの一部と考えられる
1993年から頻繁に引用される研究からは、
個々の皮膚病変のパターン、②表皮の剥離を伴う体表面積の推定(水疱またはびらん)
に基づく多形性紅斑、SJS、TENの臨床分類が提案されている
多型紅斑の原因

多型紅斑の鑑別診断

多型紅斑、SJS、TENの鑑別特徴

病因と病態生理
多形性紅斑は、20歳から40歳の成人で発生するが、全年齢の患者で発症しうる
単純ヘルペスウイルス(HSV)は、最も一般的な病因で、症例の50%以上を占める
多形性紅斑に関連した薬は、ほとんどがバルビツール酸塩、ヒダントイン、非ステロイド性抗炎症薬、ペニシリン、フェノチアジン、スルホンアミドである
ワクチン(ジフテリア、破傷風に関連した多形性紅斑が報告、B型肝炎、天然痘)、他のウイルス(水痘帯状疱疹、C型肝炎、サイトメガロウイルス、ヒト免疫不全ウイルス) 、および新しい薬(カンデサルタンシレキセチル、ロフェコキシブ、メトホルミン、アダリムマブ、ブプロピオン、シプロフロキサシン
再発性多発性紅斑は、しばしば、HSV-1/2の再活性化に続発する。HSVは臨床的症状がないことがある。臨床的に明らかなHSV感染を伴わずに、多形性紅斑または多形性紅斑のエピソードを伴わずに、臨床的に明らかなHSV再活性化を有しうる
ヘルペス関連多形紅斑の病因は十分に研究されており、遅延型過敏症反応と一致している。CD4 +細胞が、ウイルス抗原に反応してIFN-の産生を引き起こし、炎症カスケードを開始する。
薬物関連の多形性紅斑病変は、ヘルペス関連多形性紅斑のように腫瘍壊死因子αが陽性であり、インターフェロンは陽性でないことから、様々な機序が示唆されている。
臨床経過
多型紅斑は、通常は軽度または症状を示さないSelf limittingな発疹である。患者は、紅斑に掻痒感や灼熱感を感じることがある。
病変は境界が定められた赤色/ピンク色の斑として始まり、その後丘疹になる。丘疹は徐々に拡大しうる。丘疹/斑の中央部分は徐々に暗赤色/茶色/紫色になる。病変部の中央は、痂皮や水疱が生じうる。
特徴的な「標的病変」は、規則的な丸い形と3つの同心円のゾーンからなる(中央が暗赤色、淡ピンク色/浮腫性域、周辺の赤色リング)。
標的病変はその名紅斑「多」、種々の臨床形態の病変は、通常、存在する場合、数日発症後まで明らかではないかもしれない
多紅斑の皮膚病変は、通常、遠位末端に対称的に現れ、近位に進行する(手の背側、四肢伸側が最も特徴的)

粘膜病変が生じることがあるが、通常は口腔に限定される
多形性紅斑は、後遺症なしに3〜5週間で自発的に消失するが再発することがある。再発する患者は、1年に複数のエピソードを起こす可能性がある(再発性多発性紅斑を有する65人の患者を対象とした研究において、1年当たりの平均発作数は6であり2〜24の範囲であった。Br J Dermatol 1993;128:542-5 より)
Diagnosis
多形紅斑は臨床的に診断される。
生検所見は多形性紅斑に固有のものではないため、臨床像が明確である場合は皮膚生検が必要ない。
非定型例や再発性多形性紅斑(HSV感染がない)は、生検は他の診断を除外するために役立つ。
検査(例:HSV-1/2のIgM/IgG)は、HSV感染を確認できるが、必須でない。
皮膚生検の結果は、臨床形態および病変の存続期間ならびに検体が得られる病変の領域(すなわち、中央部分または外側領域)によって変化する。
赤色斑および丘疹の初期段階は、血管周囲の単核細胞浸潤を示す。
標的病変の浮腫性領域の生検では、組織学的に顕著な皮膚浮腫を示すことがある。壊死ケラチノサイトまたは表皮の変化は、通常、標的病変の中央部分で起こる。
多型紅斑の鑑別診断は、薬疹、多型光発疹、蕁麻疹、蕁麻疹様血管炎、ウイルスexanthems、および他の過敏性反応を含ちま。
多形紅斑は、多くが発症時に蕁麻疹に似ているので、臨床的特徴を区別することが重要。
典型的な症例における多形性紅斑の個々の病変は、少なくとも1週間存在し、固定/標的病変に進行するものもある。
対照的に、蕁麻疹病変は、24時間以内に同じ部位に存在する/病変の中心は、正常または境界のように赤く見える。
標的病変がバラ色粃糖疹、エリテマトーデス、血管炎、figurate Erythemas(回状紅斑)に類似し得る。水疱性病変が存在する場合、多形性紅斑は自己免疫性水疱性疾患と区別されなければならない。
Treatment
多紅紅斑の管理は、可能であれば病因を決定することを含む。
疑わしい感染症を治療する、または 被疑薬を中止することである。
軽度の多形紅斑は治療を必要としない。
経口抗ヒスタミン薬および局所ステロイドを使用して、症状を緩和することができる。
最近または既存のHSV感染を有する患者において、経口アシクロビルによる早期治療は、皮膚病変の数および持続時間を減少させることができる。(局所アシクロビルは、ヘルペス関連多形性紅斑には効果がない)
プレドニゾン:40-80㎎/日を1〜2週間投与しで早急に漸減する。
(使用には議論がある。ヘルペス関連多形紅斑を有する患者では、PSLがHSV耐性を低下させHSV感染が再発し多発性紅斑を再発させる可能性がある)
再発性多発性紅斑は、HSV因子がないとしても、経口アシクロビル(1日2回400mg)で治療する。経口アシクロビルは、多発性紅斑の再発抑制に有効であることが示されている。
バラシクロビル(1日500~1000mg)およびファムシクロビル(1日125~250mg)は、アシクロビルより経口バイオアベイラビリティが高く、アシクロビルに対する反応がない患者で試みる。患者は4か月の間再発がない場合に、最終的に薬剤を中止することができる。
抗ウイルス療法の使用にもかかわらず、再発性多形紅斑を有する患者は、さらなる治療のために皮膚科医に紹介すべきである。
その場合は、抗マラリア薬、アザチオプリン(イムラン; 1日あたり100〜150mg)、シクロスポリン(サンディミュン)、サリドマイド(サロミド)などの効果が報告されている。これらの薬物療法は一部患者に有益だが、支持する根拠は限定的である。
心不全のβ遮断薬の使い方
循環薬の選び方と使い分けより抜粋
結論から言う

まとめると

高血圧心不全はカルベジロール、低血圧性心不全はビソプロロール
喘息や閉塞性動脈硬化症はビソプロロール
肝障害はビソプロロール、腎障害はカルベジロール
これらの縛りがなければ④による不整脈・突然死予防効果を期待してカルベジロールを選ぶ
βブロッカーの重要性
Lancetで1993年にWaagsteinらが拡張型心筋症患者でプラセボよりメトプロロールが突然死・心不全再入院が34%少なく、左室駆出率の改善率もメトプロロールが優れるありと報告。
MUCHA試験では少量でも十分な効果が得られ高容量では副作用が増えたと報告、HF-ACTIONのサブ解析では全死亡と入院はカルベジロールの用量と有意な逆相関を示した⇒両試験を考えると『βブロッカーは少量でも有効だが、副作用が出ない限りできるだけ増量することが望ましい』と考えられる
HF-ACTIONは欧米人対象で容量がカルベジロール50㎎/日まで増量が推奨されている。日本人では現実的に
βブロッカー推奨維持量は
カルベジロール:20㎎/日、ビソプロロール:5㎎/日 である
心不全患者に対するβブロッカー増量目安は、
安静時心拍50bpmを目標 または 非忍容性を満たすまで
なぜカルベジロールが血圧降下作用が強いか?
β2受容体の活性化は血管弛緩、不活性は血管収縮を引き起こす。
α1受容体の活性化は血管収縮、不活性は血管拡張を引き起こす。
カルベジロールは、αブロッキング効果があるため血管拡張し血圧が下がる
伝染性膿痂疹(疫学、原因、診断、治療)小児から高齢者まで
Impetigo
Up to dateより抜粋、last updated:Sep11, 2016.
<膿痂疹(Impetigo)の一般事項>
・膿痂疹は、小児で最もCommonな表在性細菌感染症、全年齢でおこる
・感染は暖かい、湿った状態で起こりやすく、密接な接触で広がる
・危険因子に、貧困、不衛生、疥癬があげられる
・原発性膿痂疹(正常な皮膚への直接細菌浸潤)または二次性膿痂疹(擦過傷、外傷、虫刺さされ、湿疹)に分類され二次性膿痂疹の発生は、「Impetiginization」と呼ばれる
・膿痂疹は、2歳から5歳の子供で最も多い
微生物:
・主病原体は黄色ブドウ球菌、β溶血性連鎖球菌(主にA群、時にはC・Gなど)
・溶連菌は皮膚から上気道に細菌が移動しうる
・1940年代と1950年代に黄色ブドウ球菌が多く、その後A群連鎖球菌が一般的になったが、1990年代より再び黄色ブドウ球菌が一般的になった。MRSAも稀に報告され、中国で小児膿痂疹の黄色ブドウ球菌例のうち1%、本邦では2011年の文献で膿痂疹を患う小児黄色ブドウ球菌分離株のうち10%でMRSAが検出された
・A群連鎖球菌(GAS)、黄色ブドウ球菌のキャリアは、膿痂疹の素因となりうる
臨床兆候:
非水疱性膿痂疹(Non-bullous impetigo)、水疱性膿痂疹、膿瘡(Ecthyma)、膿痂疹後の連鎖球菌性糸球体腎炎およびリウマチ熱の報告がある
*水疱性膿痂疹は、表皮層に裂け目を引き起こす毒素を産生する黄色ブドウ球菌(S.aureus)の菌株によって引き起こされる。膿瘡はA群β溶連菌で引き起こされる。
<膿痂疹の臨床病型>
・非水疱性膿痂疹:
最も一般的な形態、紅斑に囲まれた小疱疹に進行する丘疹として始まり、拡大して自壊し特徴的な金色の痂皮を伴う膿疱となる。通常、約1週間の経過で起こる、局所リンパ管炎が起こることがあるが、全身症状は通常ない
・水疱性膿痂疹:
主に幼児に見られる膿痂疹の一種、小疱が黄色透明の液体を伴う痂皮を形成するために拡大し、後で濃くなり濁っていく。破裂した水疱は薄い茶色の殻を残す。通常、非水疱性膿痂疹より病変が少なく、体幹の多い
成人の水疱性膿痂疹はヒト免疫不全ウイルス(HIV)感染症の臨床症状である場合がある。水疱性膿痂疹は、デスモグレイン1を標的とすることによって表面表皮における細胞接着の喪失を引き起こす毒素である剥離性毒素Aを産生する黄色ブドウ球菌の菌株が原因である(天疱瘡の病態生理と類似)
・膿瘡:
潰瘍を伴う膿痂疹形態、病変は表皮を通り抜け真皮まで広がっている。
膿痂疹合併症↓
・溶連菌後糸球体腎炎:
感染後1〜2週間以内に発生することが多い、溶連菌膿痂疹の合併症である、膿痂疹に対する抗菌薬治療が溶連菌性糸球体腎炎のリスクを低下させるかどうかは不明である
・リウマチ熱:
膿皮症と急性リウマチ熱との関連が提唱されているが、まだ実証されていない。(アボリジニ;オーストラリアでは、連鎖球菌咽頭炎は稀にしか報告されておらず膿皮症は非常に一般的かつ急性リウマチ熱が心臓病の主原因である。報告では膿痂疹などの連鎖球菌性皮膚感染が咽頭炎に対して免疫を誘導し防御的に働くと仮定しているが、急性リウマチ熱のような合併症が続く可能性があると指摘している。)
<診断>
膿痂疹の診断は、多くの場合臨床症状に基づいて行う
非水疱性膿痂疹、水疱性膿痂疹、膿瘡の主要な臨床所見は以下のとおり:
・非水疱性膿痂疹:丘疹、小胞、および膿疱が急速に崩壊して金色の付着した痂皮を形成する。顔または四肢に位置することが多い。
・水疱性膿痂疹:破裂して薄い茶色の外皮を残す揮発性の液体で満たされた水疱。体幹に位置することが多い。
・膿瘡:痂皮が重なり、青紫の境界がせりあがった打ち抜き(Punched-out)潰瘍病変
黄色ブドウ球菌/連鎖球菌が原因であるか特定するためグラム染色で膿または滲出物の培養が推奨される。しかし、典型的な臨床所見を有する患者では培養なしで治療を開始してもよい
<検査>
溶連菌の血清学的抗体検査は、膿痂疹の診断には有用ではない(抗ストレプトリジンO(ASO)の反応が弱いため:皮膚脂質がストレプトリジンO反応を抑制する)。抗デオキシリボヌクレアーゼB(抗DNase B)および抗ヒアルロニダーゼ(AHT)反応が溶連菌皮膚感染後のASO反応よりも信頼性が高い
<鑑別診断>
臨床所見に基づいて膿痂疹以外の鑑別診断を立てる。グラム染色および培養が診断を確認するために有用
・ 非水疱性膿痂疹:接触皮膚炎、白癬、ヘルペス感染など(特徴的な黄金の痂皮は、膿痂疹を疑う)
・ 水疱性膿痂疹:膿痂疹に水疱を伴う、他の水疱性皮膚疾患と区別する必要があるります。例としては、自己免疫性皮膚疾患、急性接触皮膚炎、薬剤、火傷、昆虫咬傷反応、角層下膿疱症(Sneddon-Wilkinson 病 )
・膿瘡:マイコバクテリア、深部真菌感染、膿皮症などの限局性潰瘍を引き起こす可能性のある他疾患
<治療>
一般的には意見が一致した標準療法はない(Kon
ingら, Chocrane Datebase syst rev 2012 Jan 18, Interventions for impetigo.)
*Up to dateでは治療方針は米国感染症協会;IDSAのSSTI 治療2014年版ガイドラインより引用, Clin Infect Dis 2014; 59(2):147を引用/参照]。
・膿痂疹の治療は、感染の拡大防止、不快感の軽減、美容的外観の改善に重要
・水疱性および非水疱性膿痂疹は、局所療法または経口療法のいずれかで治療する
・限局性病変には局所療法、多数病変は経口療法が推奨される
・膿瘡は常に経口療法で治療すべきである
・医療現場では、抗生物質治療開始後24時間まで感染蔓延を避けるための接触予防策を行う
限局性(少数)膿痂疹:
局所療法を施行すべき(グレード1A)
― 副作用が少なく、経口療法に比べて細菌耐性に寄与するリスクが低い、局所治療は5日間が推奨
・ムピロシン(バクトロバン軟膏)、レタパムリン(アルタゴ軟膏):同等に有効な局所療法でありムピロシンを毎日3回、レタパムリンを1日2回塗布する。・フシジン酸: 有効でありうるが、フシジン酸の使用が頻回である地域では黄色ブドウ球菌のフシジン酸抵抗性が増加することがある。(フシジン酸は米国では入手不可)
・バシトラシン軟膏:バシトラシン/ネオマイシン/ポリミキシンBからなる三重抗生物質軟膏)は治療に有効でない可能性があり接触性皮膚炎を引き起こし得るため推奨されない
広範囲の膿痂疹、膿瘡:
内服治療(グレード1B)、経口抗生物質治療は7日間が推奨
全身性抗生物質:黄色ブドウ球菌および連鎖球菌感染症がTargetである(選択する抗生物質は、黄色ブドウ球菌および連鎖球菌感染の両方に有効であるものを選択すべきである)
黄色ブドウ球菌は通常メチシリン感受性なので、ジクロキサシリンとケファレキシン(第一世代セフェム)は適切な治療法である。

<特殊な治療が必要なケース>
/・連鎖球菌膿痂疹:広範囲の膿痂疹または膿瘡で連鎖球菌のみが検出された場合、経口ペニシリンが好ましい治療法である
・MRSA膿痂疹:MRSA感染の疑いがある Or MRSA確定患者は、感受性があればドキシサイクリン、クリンダマイシン、ST合剤のいずれかで治療する(8歳以下の子供は薬物誘発性歯牙着色が懸念されるためドキシサイクリンで治療すべきでない)
・MRSA耐性が広範囲に広がり、抵抗性の獲得が治療で発症する可能性があるため、膿痂疹の治療にはフルオロキノロンを使用すべきではない
(私見⇒日本ではフルオロキノロン製剤は、内服;オゼックス、塗布;アクアチムクリーム Up to date本文でも一般的に塗布抗菌剤は薬剤耐性を誘導しにくいと記述されてはいる)
・膿痂疹のアウトブレイク:局所療法ではなく内服療法を推奨する
・疥癬との重複:膿痂疹患者の疥癬治療は、疥癬の抗菌薬治療への反応を最適化し、疥癬の発生率が高い地域で膿痂疹の有病率を減らすために重要である
<フォローアップ>
・病変はやさしく洗浄可である、手洗いは蔓延を減らすために重要である
・膿痂疹の改善を、適切な抗生物質治療期間内に留意して確認すべきである。抗生物質に応答しない場合、耐性病原体または誤診断の可能性を考慮する
<学校>
効果的な抗菌剤治療を開始してから24時間後
小児における尿路感染症(Urinary Tract Infection:UTI)の基本
小児内科49:536-541,2017より
【尿路感染症の疫学】
定義:通常無菌である尿路から有意な細菌がされること
膀胱尿管逆流症(Vesicourethral Reflux:VUR)や先天性腎尿路異常(Congenital anomalies of the kidney and urinary tract:CAKUT, 低形成異形性腎など)が発見されることが多く、感染反復は腎機能障害(逆流性腎症)の原因となるため重要
上部UTIは、低年齢、1歳未満の男児、1歳以降の女児、白人とヒスパニック、包茎がリスク因子
【起炎菌】複数細菌の検出は合併尿路奇形の存在を疑う
70-80%が大腸菌、次に腸球菌が多い。その他にクレブシエラ、プロテウス、エンテロバクター、緑膿菌などのGNR、B群溶連菌、黄色ブドウ球菌、表皮ブドウ球菌などのGPCが報告
【診断】
2011年にアメリカ小児学会(AAP)より、『白血球尿(WBC>5/HPF)と有意な細菌が存在する』と定義
実臨床では、白血球尿が存在しないUTIも存在するため注意深い観察が必要
【臨床症状】
上部UTI:高熱以外に、活気不良や体重増加不良/側腹部痛や背部痛/消化器症状などの全身症状を伴うが多い
下部UTI:膀胱刺激症状のみ
【検査所見】
尿検査:パック尿は尿培養で擬陽性率が80-90%と非常に効率であるため診断に適さない
白血球沈査>5/HPF、好中球エラスターゼ(特異度低い)、亜硝酸(感度低い、特異度高い)
カテーテル採尿:104-5/ml 以上
クリーンキャッチ尿(採取前は外陰部消毒):105/ml 以上
尿培養が最も重要だが、結果判明まで18-24h以上要するため、尿グラム染色と尿検査を手掛かりに暫定診断することとなる
【血液検査】下部との鑑別のため特異的検査はない
上部UTIでは菌血症を合併(新生児:31%、1-3か月:21%、3か月以上:5%)であるため採血時は血液培養も採取する
【画像検査】
画像検査の目的は、①VURをはじめとするCAKUTの発見、②急性期難治例に対する膿瘍や閉塞性障害の診断、③腎瘢痕の評価
超音波検査
CAKUTの発見/膿瘍や閉塞性障害の評価(VURの発見や腎瘢痕の評価には適さない)
VCUG(Voiding cysto-urethrography)
VURだけでなく、膀胱容量や形態/後部尿道弁など下部尿路形態も評価するため排尿時膀胱“尿道”造影になるように行う
AAPの2011年ガイドラインでは、適応を制限する方向となった(上部UTI再発、臨床経過が非典型例、超音波異常に行う)
ヨーロッパの2015年ガイドラインでは、女児および1歳未満男児には全例に行う
DMSAシンチグラフィー
急性期(上部UTI発症後1か月以内):上部UTI診断/将来的な腎瘢痕リスク者の同定、慢性期(発症4-6か月後):腎瘢痕評価 の2つの目的で実施される。
- 急性期
低年例で感度が低い/鎮静が必要/全施設で実施できない などの問題点がありガイドラインでの推奨まで至っていない
- 慢性期
腎瘢痕の評価のため有用、逆流性腎症フォーラムからStage分類が提案されている
【治療】
上部UTI:各施設のUTI起炎菌の感受性を考慮して抗菌剤を選択する
治療の遅れによる状態悪化/腎瘢痕の形成を防ぐために速やかに治療を開始する
計7~14日間の投与が推奨、急性巣状細菌性腎炎は3週間、腎膿瘍は膿瘍消失まで投与
(日本の医療環境では、入院で経静脈的抗菌剤を開始し解熱24時間を確認後に内服に変更し計10-14日間の抗菌剤投与が実際的である)
下部UTI:
2-4日間の投与が推奨
日本では5日ほどの内服が行われることが多い(日本ではST合剤耐性細菌が多い)
【慢性期管理】CAP(Continuous antibiotic prophylaxis:抗菌薬予防内服)に関して
1999年のAAPガイドラインでは、全例にCAPが推奨されていた。2000後半にCAPの効果に否定的なRCTが報告されて以後は適応に関して議論中である
セフェム系抗菌薬の耐性誘発を考慮すると可能な限りST合剤の内服が望ましいと思われる
各RCTの比較
東京都立小児総合医療センター腎臓内科では下記を適応としている
- 生後1か月未満のVUR症例
- 生後1か月以上のVUR 3度以上
- 排尿機能異常症例に関しては、VUR 1-2度でも考慮
生後1か月未満:セファレキシン 5-10㎎/㎏/日分1 寝る前
生後1か月以上:ST合剤 0.0125-0.025g/㎏/分1 寝る前
鉄欠乏性貧血:軽症でも(どのくらいで)鉄を補充すべきか?
日本には鉄欠乏性貧血の乳児におけるガイドラインはない.
【臨床症状・検査所見】
症状:軽度~中等度貧血までは無症状が多い、細胞分裂が早い皮膚・粘膜症状が多い
心臓肥大、Restless leg症候群、舌乳頭萎縮、舌・口角炎、青色強膜、匙状爪、Pica、Pagophagia、難聴、精神運動発達障害
【診断と検査所見】
・貧血の定義:下図
ヘモグロビン濃度(g/dl)に基づいた貧血(Lancet 2006 387 10021 907-916より)
|
|
軽度 |
中等度 |
高度 |
|
6ヶ月〜4歳 |
11未満 |
10未満 |
7未満 |
|
5歳〜11歳 |
11.5未満 |
11未満 |
8未満 |
|
12歳〜14歳 |
12未満 |
11未満 |
8未満 |
・鉄欠乏症の定義:5歳未満 フェリチン<12μg/dl、5歳以上 フェリチン<15μg/dl
・鉄欠乏性貧血の定義:貧血+鉄欠乏症 (+他に原因がない)
CQ 軽症の鉄欠乏性貧血に鉄補充を行うべきか?
・学童期、青年期
貧血の有無に関わらず鉄欠乏症は認知機能障害を起こしうる。
Pediatrics. 2001;107(6):1381 より
・新生児/乳児/幼児
貧血の有無に関わらず鉄欠乏症は、精神発達障害を起こしうる。
そのため米国小児科学会では、発達への影響を予防するため生後4カ月からの鉄補充を推奨している。
生後6カ月を越えると母乳中の鉄のみでは必要量を満たさず鉄欠乏症になりやすい。しかし、日本では離乳期初期から十分な鉄を摂れる市販の離乳食がない。
日本では、乳児における鉄欠乏性貧血のまとまった報告が少なく、乳児期の鉄欠乏性貧血が無症状で一過性と考えられているため小児科医に関心をもたれていないことが問題である。鉄欠乏症では、鉄補充を推奨する。
小児科臨床. 2014;67(12):121-6 より
|
Take home message 貧血の有無に関わらず、鉄欠乏症は鉄補充を行う |